24時間眼圧推移
第Ⅱ相臨床薬理試験
(承認時評価資料)
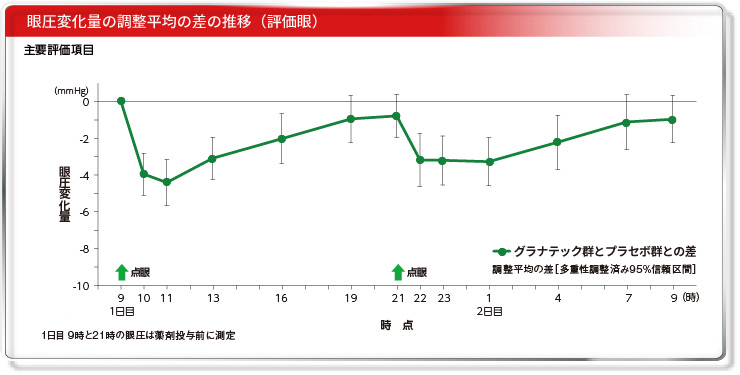
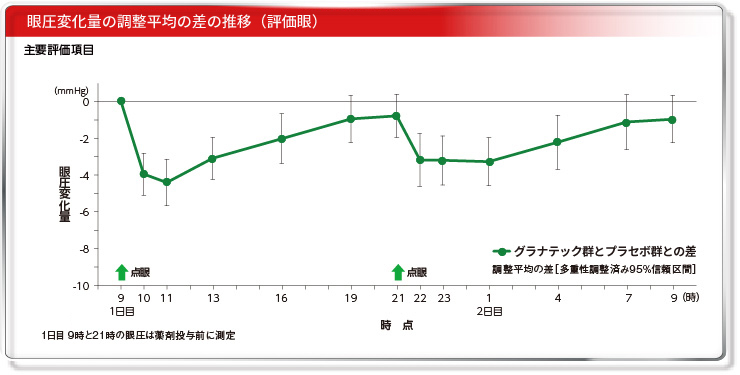
グラナテックの眼圧下降効果は、投与2時間後に最大となり、昼も夜も同様の眼圧下降パターンを示しました。
副作用は、プラセボ投与時に28例中3例(10.7%)3件、リパスジル塩酸塩水和物0.2%点眼液投与時に28例中22例(78.6%)24件、グラナテック投与時に28例中27例(96.4%)33件発現した。副作用の内訳は、結膜充血(プラセボ1例1件、リパスジル0.2%22例22件、グラナテック27例28件)、点状角膜炎(プラセボ2例2件、グラナテック2例2件)、眼の異常感(グラナテック1例1件)、眼精疲労(グラナテック1例1件)、結膜濾胞(グラナテック1例1件)、角膜びらん(リパスジル0.2%1例1件)、虹彩炎(リパスジル0.2%1例1件)であった。結膜充血は全てが軽度であり、多くは投与1時間以内に発現し、1~3時間で消失する一過性のものであった。本試験において重篤な副作用及び投与中止に至った副作用は報告されなかった。
副作用は、プラセボ投与時に28例中3例(10.7%)3件、リパスジル塩酸塩水和物0.2%点眼液投与時に28例中22例(78.6%)24件、グラナテック投与時に28例中27例(96.4%)33件発現した。副作用の内訳は、結膜充血(プラセボ1例1件、リパスジル0.2%22例22件、グラナテック27例28件)、点状角膜炎(プラセボ2例2件、グラナテック2例2件)、眼の異常感(グラナテック1例1件)、眼精疲労(グラナテック1例1件)、結膜濾胞(グラナテック1例1件)、角膜びらん(リパスジル0.2%1例1件)、虹彩炎(リパスジル0.2%1例1件)であった。結膜充血は全てが軽度であり、多くは投与1時間以内に発現し、1~3時間で消失する一過性のものであった。本試験において重篤な副作用及び投与中止に至った副作用は報告されなかった。
-
目 的:プラセボ、リパスジル塩酸塩水和物0.2%点眼液、グラナテック(リパスジル塩酸塩水和物0.4%点眼液)を点眼した際の眼圧を入院管理下で測定し、その24時間の眼圧の推移からグラナテックの眼圧下降効果を検討する。対 象:原発開放隅角緑内障又は高眼圧症患者28例投与方法:プラセボ、リパスジル塩酸塩水和物0.2%点眼液、グラナテックを両眼に1回1滴、1日2回、3日間(1用量/日、計3日間)点眼した。
評価項目: [有効性] [有効性]
主要評価項目:評価眼の投与前値からの眼圧値変化量。 [安全性] [安全性]
評価項目:副作用発現率ほか 試験デザイン:多施設共同無作為化プラセボ対照非盲検3群3期ラテン方格型クロスオーバー試験




