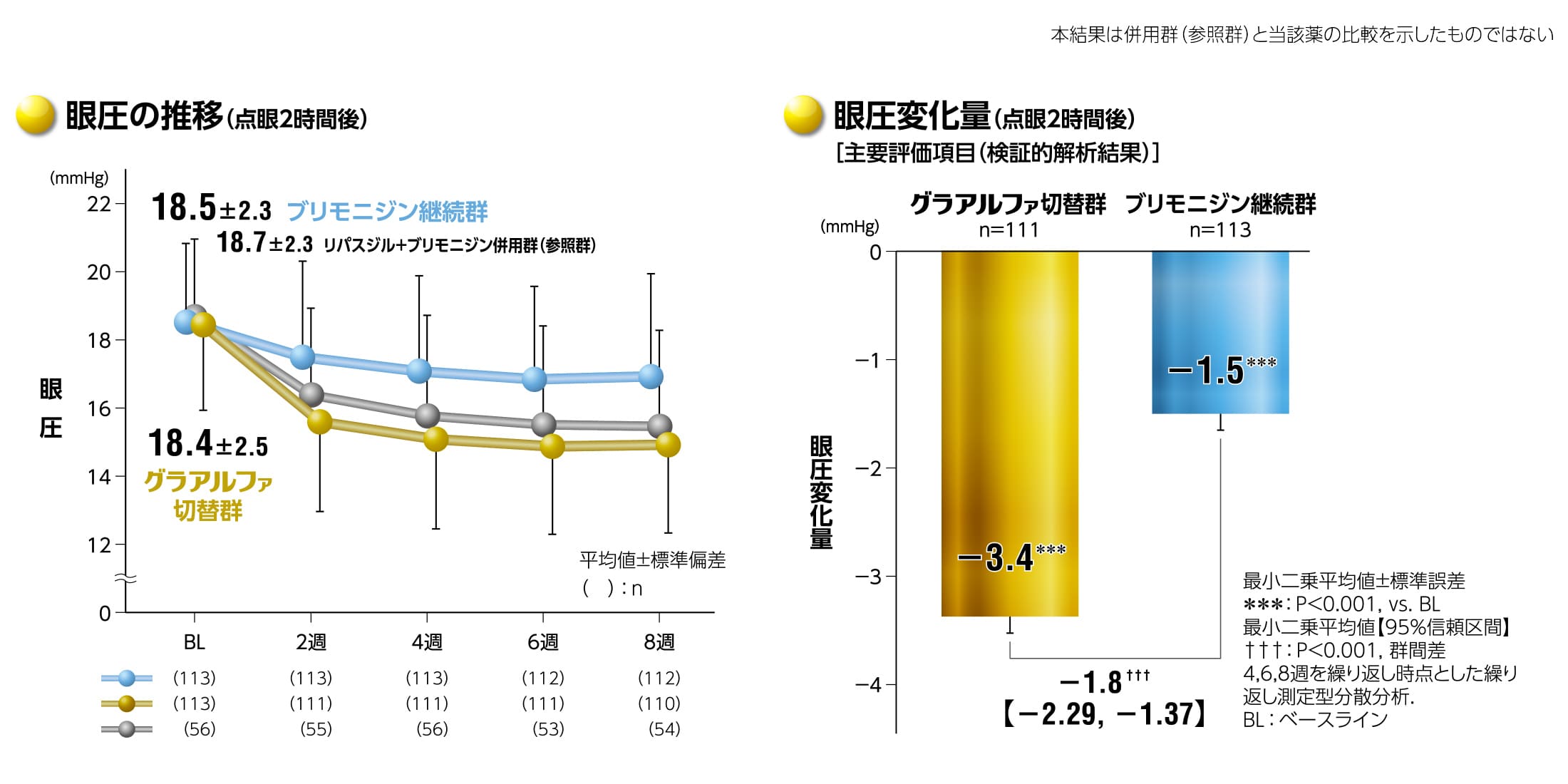
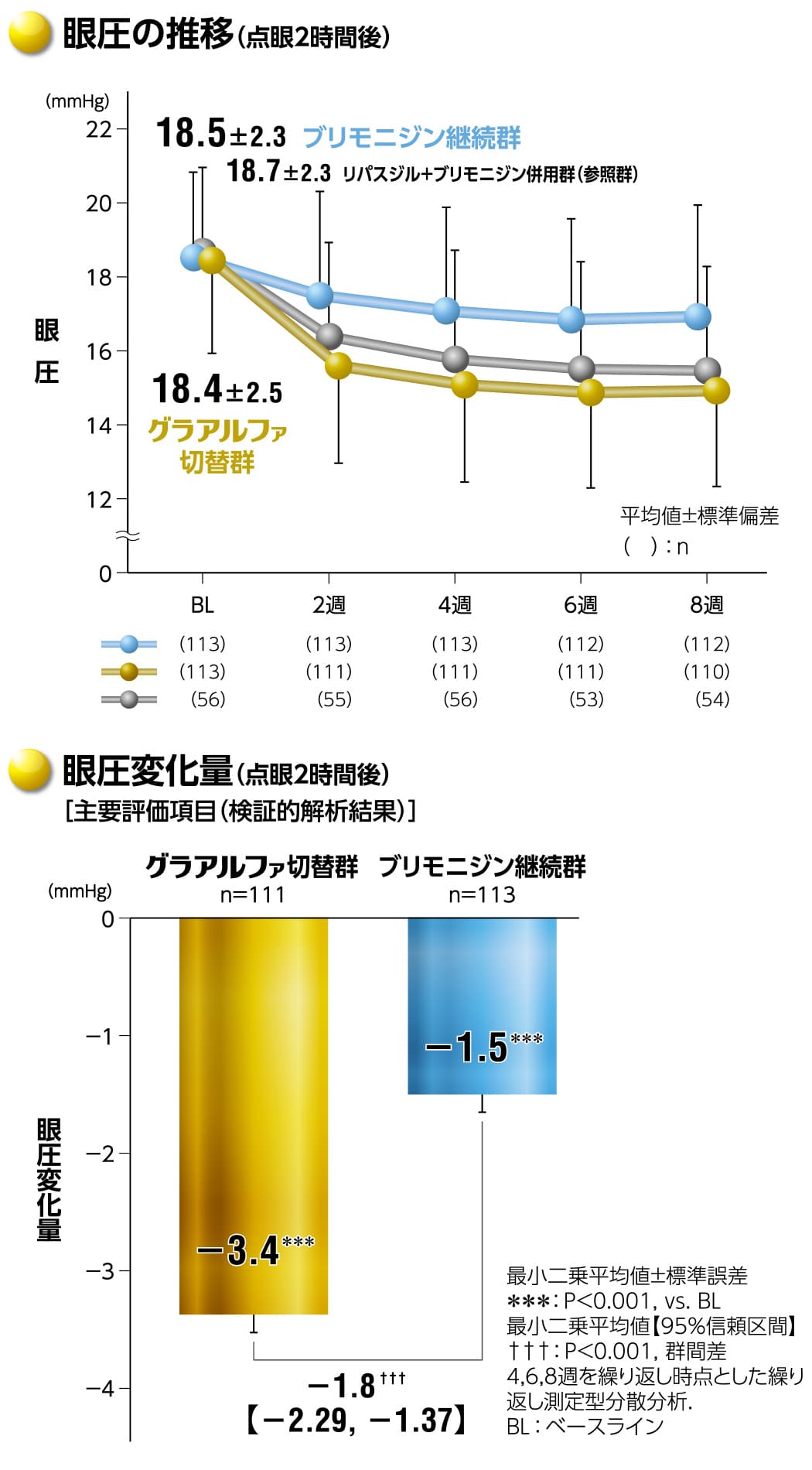
グラアルファの眼圧下降効果(ブリモニジンからの切替)
グラアルファ配合点眼液は、ブリモニジン0.1%※単剤治療に対して眼圧下降効果の優越性が検証されました※ブリモニジン酒石酸塩0.1%
興和(株)社内資料:国内第Ⅲ相ブリモニジン点眼液対照比較試験(承認時評価資料)
グラアルファの眼圧下降効果
(ブリモニジンからの切替)
グラアルファ配合点眼液は、ブリモニジン0.1%※単剤治療に対して眼圧下降効果の優越性が検証されました※ブリモニジン酒石酸塩0.1%
興和(株)社内資料:国内第Ⅲ相ブリモニジン点眼液対照比較試験(承認時評価資料)
副作用はグラアルファ切替群で113例中63例(55.8%)79件、ブリモニジン継続群で113例中15例(13.3%)19件、併用群で56例中32例(57.1%)43件認められた。最も頻度が高かったものは結膜充血で、グラアルファ切替群61例(54.0%)63件、ブリモニジン継続群8例(7.1%)8件、併用群32例(57.1%)34件であった。治験中止の原因となった副作用はグラアルファ切替群3例5件(結膜充血2件、動悸、眼瞼炎、アレルギー性結膜炎各1件)、ブリモニジン継続群1例1件(アレルギー性結膜炎)、併用群2例2件(アレルギー性結膜炎、結膜充血)であった。
副作用はグラアルファ切替群で113例中63例(55.8%)79件、ブリモニジン継続群で113例中15例(13.3%)19件、併用群で56例中32例(57.1%)43件認められた。最も頻度が高かったものは結膜充血で、グラアルファ切替群61例(54.0%)63件、ブリモニジン継続群8例(7.1%)8件、併用群32例(57.1%)34件であった。治験中止の原因となった副作用はグラアルファ切替群3例5件(結膜充血2件、動悸、眼瞼炎、アレルギー性結膜炎各1件)、ブリモニジン継続群1例1件(アレルギー性結膜炎)、併用群2例2件(アレルギー性結膜炎、結膜充血)であった。
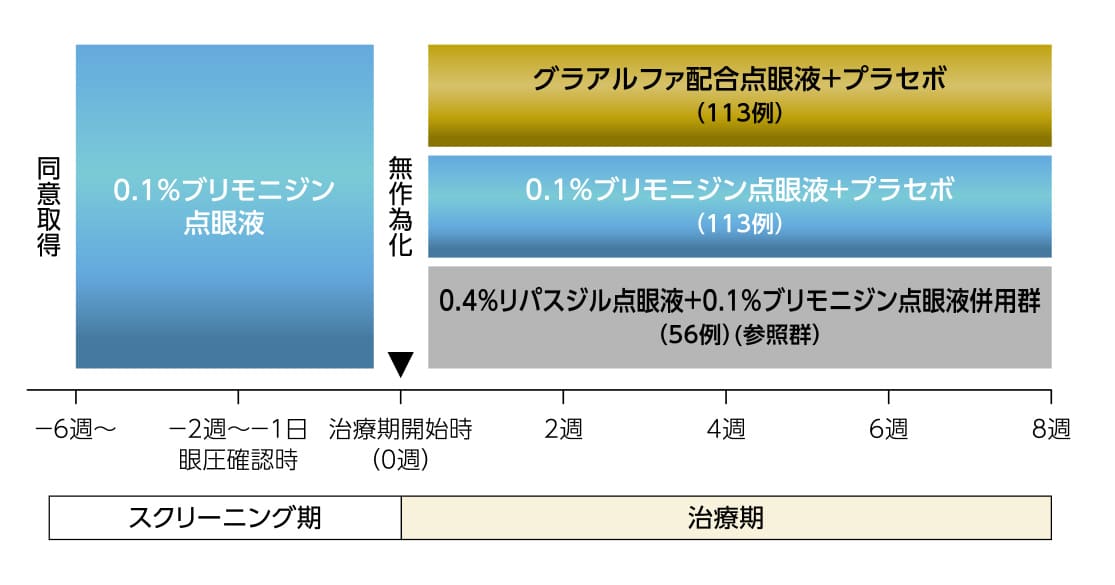
第Ⅲ相ブリモニジン点眼液対照比較試験
- 目 的:
- グラアルファ配合点眼液を8週間投与したときの有効性及び安全性を検討し、眼圧下降効果について0.1%ブリモニジン点眼液を比較対照に検証する。また、0.4%リパスジル点眼液と0.1%ブリモニジン点眼液併用時の眼圧下降効果及び安全性を確認する。
- 試験デザイン:
- 多施設共同、無作為化、単遮蔽、実薬対照、並行群間比較試験
- 対 象:
- 0.1%ブリモニジン点眼液で効果不十分な広義原発開放隅角緑内障または高眼圧症患者
- 投与方法:
- グラアルファ配合点眼液及びプラセボ、または0.1%ブリモニジン点眼液及びプラセボを両眼に1回1滴、1日2回、8週間点眼。併用群は0.4%リパスジル点眼液及び0.1%ブリモニジン点眼液を両眼に1回1滴、1日2回、8週間点眼
- 評価項目:
- 【有効性】主要評価項目:4、6、8週時(点眼2時間後)における
べースラインからの有効性評価対象眼の眼圧変化量
【安全性】副作用発現の有無 他
次の疾患で、他の緑内障治療薬が効果不十分な場合: 緑内障、高眼圧症
効能又は効果に関連する注意(抜粋)
単剤での治療を優先すること。
第Ⅲ相ブリモニジン点眼液対照比較試験

目 的
グラアルファ配合点眼液を8週間投与したときの有効性及び安全性を検討し、眼圧下降効果について0.1%ブリモニジン点眼液を比較対照に検証する。また、0.4%リパスジル点眼液と0.1%ブリモニジン点眼液併用時の眼圧下降効果及び安全性を確認する。
試験デザイン
多施設共同、無作為化、単遮蔽、実薬対照、並行群間比較試験
対 象
0.1%ブリモニジン点眼液で効果不十分な広義原発開放隅角緑内障または高眼圧症患者
投与方法
グラアルファ配合点眼液及びプラセボ、または0.1%ブリモニジン点眼液及びプラセボを両眼に1回1滴、1日2回、8週間点眼。併用群は0.4%リパスジル点眼液及び0.1%ブリモニジン点眼液を両眼に1回1滴、1日2回、8週間点眼
評価方法
【有効性】主要評価項目:4、6、8週時(点眼2時間後)における
べースラインからの有効性評価対象眼の眼圧変化量
【安全性】副作用発現の有無 他
次の疾患で、他の緑内障治療薬が効果不十分な場合: 緑内障、高眼圧症
効能又は効果に関連する注意(抜粋)
単剤での治療を優先すること。




